A
STRÓNOMOS y físicos han postulado como origen del Universo una gran explosión, que a partir de un gas denso formó las innumerables galaxias que ahora pueblan el Universo. Una de dichas galaxias es la Vía Láctea, formada por más de 100 mil millones de estrellas, entre las que se encuentra nuestro Sol.
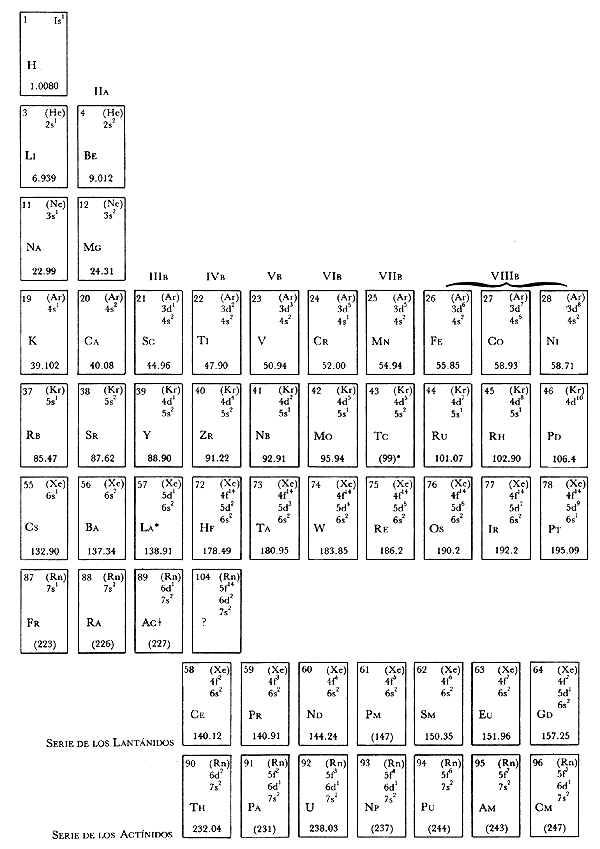
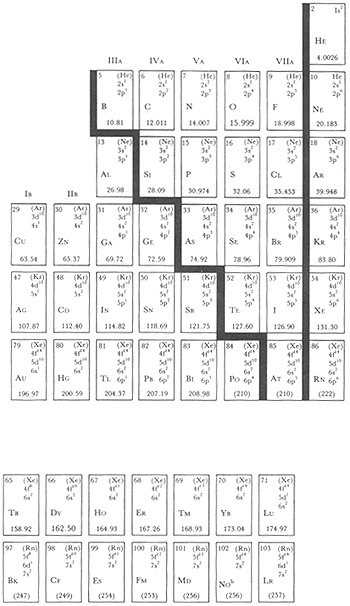
Cuando la temperatura del Universo era de alrededor de mil millones de grados, se comenzaron a formar los núcleos de los elementos. Primero se formaron los más simples, el hidrógeno (H) y el helio (He); posteriormente, en el interior de las estrellas se fueron formando los núcleos de otros elementos, hasta llegar a un número cercano a 100. Los químicos los han ido descubriendo poco a poco y han encontrado que se pueden clasificar de acuerdo con sus propiedades físicas y químicas en lo que se ha nombrado la tabla periódica de los elementos (Figura 1).
Más tarde, el Universo se fue enfriando paulatinamente hasta llegar a una temperatura de 3°K, que es la que tienen en la actualidad los espacios interestelares.
Los primeros elementos formados, que son también los más ligeros, el hidrógeno (H) y el helio (He), siguen siendo los principales constituyentes del Universo. El hidrógeno se encuentra en una proporción superior a 90% y el helio en alrededor de 8%. Estos elementos son más abundantes en el Sol y en las otras estrellas.
El hidrógeno, el elemento más sencillo y más abundante en el Universo, es un gas más ligero que el aire, por lo que, al llenar un globo con él, habrá necesidad de sujetarlo, o de lo contrario, se elevará por los aires. Esta propiedad fue aprovechada por el hombre para viajar por la atmósfera. Desde finales del siglo XVIII se construyeron máquinas voladoras para transportar hombres y equipo. Estas naves, llamadas dirigibles, eran peligrosas por el carácter inflamable del hidrógeno con el que se habían llenado.
El átomo de hidrógeno (H), como hemos dicho, el elemento más sencillo del Universo, está formado por un núcleo, llamado protón, que posee una carga positiva, la cual se encuentra neutralizada por un electrón (carga negativa).
El hidrógeno se combina con otros elementos formando moléculas. Cuando se mezcla con oxígeno en un soplete y se le prende fuego, arde produciendo flama de color azul pálido, liberando tal cantidad de calor que funde al hierro con facilidad, por lo que el soplete oxhídrico se usa para cortar láminas de acero. En esta reacción el oxígeno y el hidrógeno se combinan produciendo agua, que se escapa en forma de vapor.
Cuando en un recipiente cerrado se pone una unidad de peso de hidrógeno por 8 de oxígeno y se produce en su interior una chispa eléctrica, se provoca una explosión con formación de agua (Figura 2) sin gases sobrantes, pero si la cantidad de uno de los gases excede a las proporciones antes dichas, quedará el exceso sin reaccionar. A esto se le llama Ley de las proporciones constantes e indica que dos átomos de hidrógeno, cada uno de peso atómico 1, reaccionan con un átomo de oxígeno, con peso atómico de 16, produciendo una molécula de agua, con peso molecular de 18.
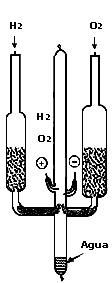
Figura 2. Síntesis de agua partiendo de hidrógeno y oxígeno mediante una chispa eléctrica.
PROPIEDADES DEL AGUA
El agua, producto formado en la combustión del hidrógeno, es la molécula más abundante en la Tierra, donde se le encuentra en sus tres estados físicos: como líquido, cubriendo las 3/4 partes de la superficie del planeta, constituyendo mares, ríos y lagos; como vapor, en grandes cantidades en la atmósfera, de donde se precipita como lluvia o nieve, y en su estado sólido (hielo), formando depósitos sobre las altas montañas y cubriendo las regiones polares y en este caso en tal cantidad, que si este hielo se fundiera, el nivel del océano subiría de tal manera que inundaría la mayor parte de las ciudades costeras y gran parte de las tierras bajas, incluyendo países enteros como Holanda, que quedaría totalmente bajo las aguas.
Esta molécula tan singular y abundante es la base de la vida; constituye más de la mitad del peso de los seres vivos. En los organismos marinos se le encuentra en una proporción de más de 90% en peso.
El agua, en estado puro, es un líquido incoloro, inodoro e insípido. Las propiedades físicas de tan importante sustancia a menudo se toman como tipo: su punto de fusión es de 0° su punto de ebullición a nivel del mar es de 100° la mayor densidad del agua se alcanza a 4°, siendo de 1 g/ml, es decir que cada mililitro pesará un gramo y por lo tanto un litro pesará un kilogramo.
Su calor específico es de 1.00 caloría por grado, por gramo, o lo que es lo mismo, un gramo de agua elevará su temperatura en un grado centígrado cuando se le suministra una cantidad de energía en forma de calor equivalente a una caloría. Por ejemplo, para elevar la temperatura de un litro de agua de 20 a 21° se necesitará suministrar una cantidad de calor equivalente a 1 000 calorías.
Como se ve, las propiedades físicas del agua son casi siempre la unidad. Esto no es accidental, pues siendo el agua el líquido más abundante y accesible y teniendo propiedades tan singulares, no es de extrañar que se le tome como referencia para medir las de otras sustancias, sobre todo si son líquidas.
El hecho de que el hielo sea menos denso que el agua líquida tiene gran importancia en el mantenimiento de la vida en las regiones frías del planeta: cuando un lago se congela, sólo lo hace en su superficie, ya que el hielo, por ser menos denso que el agua, flota sobre ella y, por ser mal conductor del calor, aisla las capas más profundas impidiendo su congelación, con lo que se logra mantener las condiciones apropiadas para la conservación de la vida. Este hecho afortunado para la vida en el planeta tiene, sin embargo, consecuencias negativas para lo que llamamos progreso de nuestra civilización, ya que los grandes témpanos de hielo (icebergs) son un peligro para la navegación en aguas frías y han destruido muchas embarcaciones.
Más aún, el agua de las tuberías, que la conducen a nuestras ciudades, se expande al congelarse, rompiendo las tuberías; lo mismo sucede con muchos recipientes rígidos que se rompen cuando se congela el agua que contienen.
LAS GRANDES RESERVAS DE AGUA COMO REGULADORAS DEL CLIMA
Como el agua se calienta o enfría más lentamente que el suelo, sirve para regular la temperatura. Es por eso que en las regiones alejadas del mar se tienen climas más extremosos que en las regiones marítimas.
El agua no sólo es abundante en la Tierra, también se ha detectado en otros cuerpos celestes. Por ejemplo, en Marte, aunque ha desaparecido de su superficie dejando vacíos los lechos de lagos y ríos, ya que la escasa gravedad del planeta (40% de la terrestre) no la pudo retener, existe agua congelada en los polos, donde se encuentra mezclada con hielo seco (CO2 sólido). También debe existir debajo de la corteza marciana, ya sea como hielo en invierno o líquida en verano. El cometa Halley la contiene en forma de hielo, como revelan los últimos informes.
AGUA OXIGENADA, PERÓXIDO DE HIDRÓGENO H2O2
El agua no es la única combinación que puede obtenerse entre hidrógeno y oxígeno. Existe además un compuesto que tiene un átomo de oxígeno más que el agua. La sustancia así formada es conocida como agua oxigenada, llamada con más propiedad peróxido de hidrógeno, cuya estructura es H2O2 o HO-OH. Esta sustancia, por tener un átomo de oxígeno extra, es inestable, es decir, libera oxígeno con facilidad para quedar como agua común. El agua oxigenada, por su facultad de liberar oxígeno, mata a muchos microbios por lo que se emplea como desinfectante de heridas, en cuyo contacto se puede ver al oxígeno desprenderse en forma de burbujas.
El agua oxigenada que se consigue en la farmacia como agente desinfectante es muy diluida, contiene sólo tres partes de agua oxigenada por 97 de agua común. El agua oxigenada que se emplea como oxidante en laboratorios químicos es más concentrada, pues contiene 30 partes de H2O2 por 70 de agua ordinaria. Esta solución tan concentrada es peligrosa, puesto que causa quemaduras al ponerse en contacto con la piel.
El agua oxigenada se emplea como decolorante, por lo que se utiliza, entre otras aplicaciones, para aclarar el color del pelo.
2 H2O2  2 H2O + O2
2 H2O + O2

No hay comentarios:
Publicar un comentario